SUSAR:可疑且非预期严重不良反应,指临床表现的性质和严重程度超出了试验药物研究者手册、已上市药品的说明书或者产品特性摘要等已有资料信息的可疑并且非预期的严重不良反应。
在药品上市的“最后一公里”——临床试验中,受试者安全是不可逾越的底线。而SUSAR作为突发风险的“警报信号”,其管理效率直接决定了试验能否继续推进。如何做到早发现、早上报、早干预?以下是关键答案。
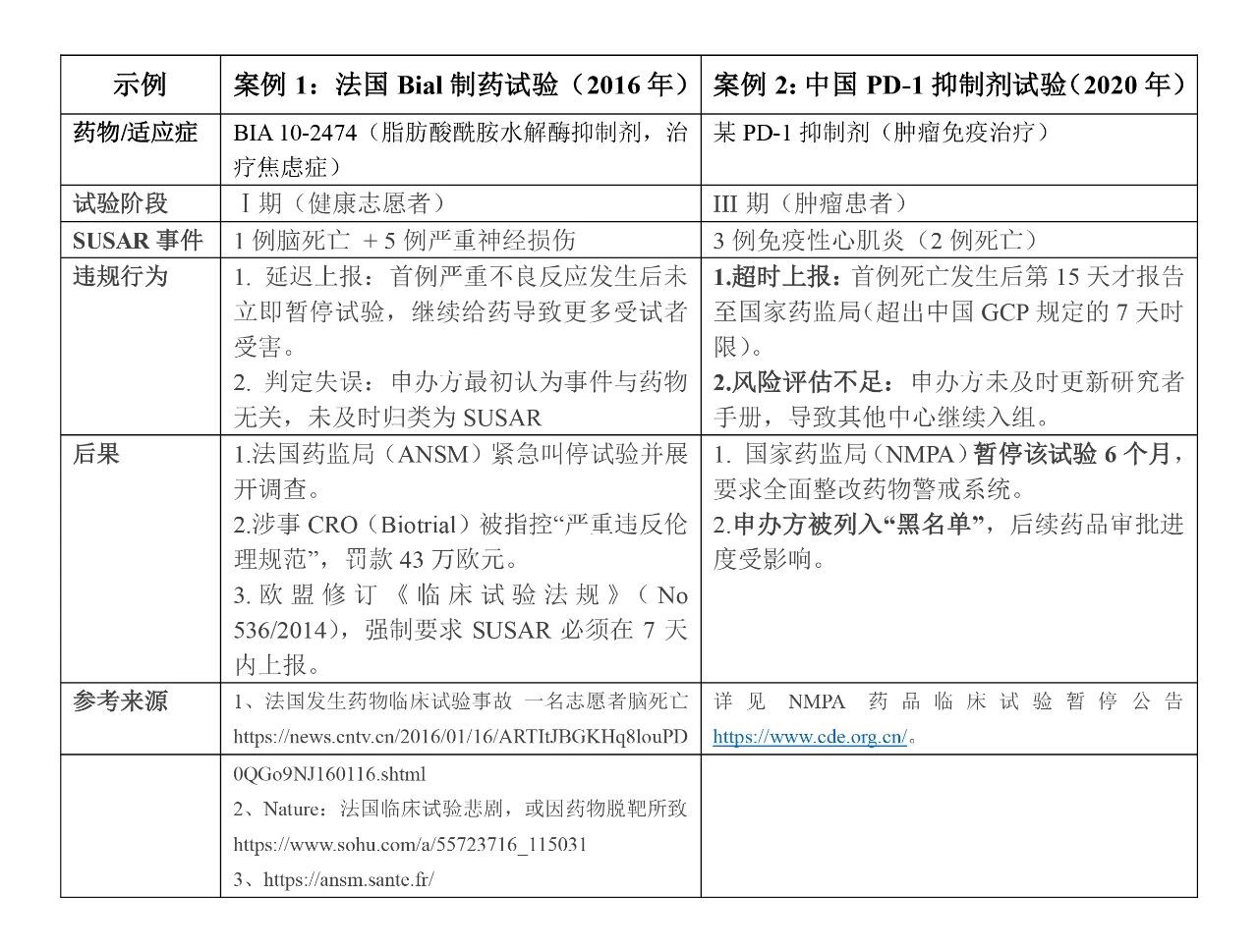
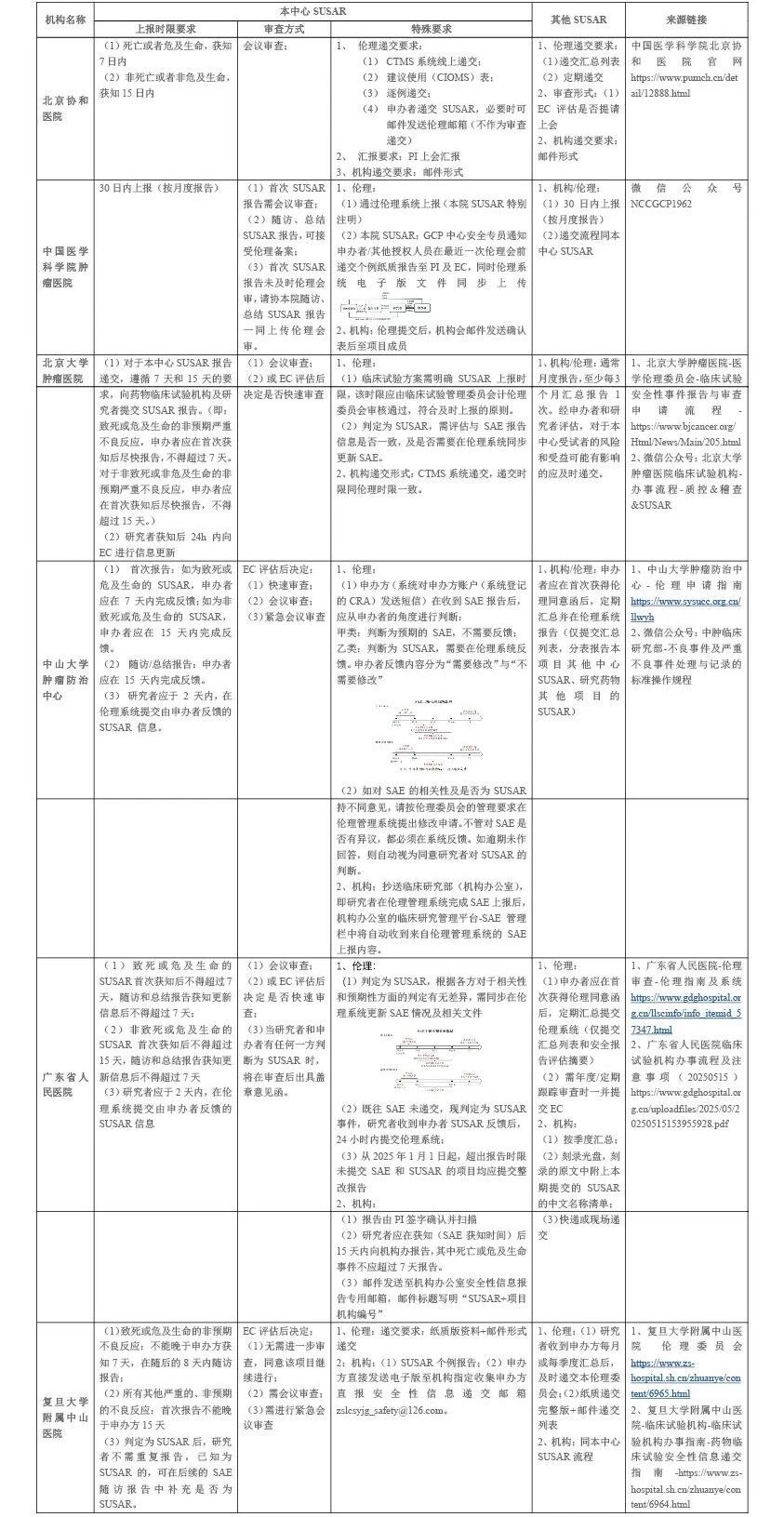
一 、某临床试验因未及时上报SUSAR被叫停: 以上案例深刻警示我们: SUSAR的及时上报是红线中的红线 申办方必须建立灵敏的药物警戒系统 研究者手册必须及时更新安全性信息 风险获益评估必须动态进行 二、为什么SUSAR是临床试验的“高压线”? 1、中国监管四重防线 (1)法律底线 《中华人民共和国药品管理法(2019版)》第十二条明确规定国家建立健全药品追溯制度。国务院药品监督管理部门应当制定统一的药品追溯标准和规范,推进药品追溯信息互通互享,实现药品可追溯。国家建立药物警戒制度,对药品不良反应及其他与用药有关的有害反应进行监测、识别、评估和控制。 (2)操作红线 《药物临床试验质量管理规范(2020 版)》第一章总则第一条明确规定“为保证药物临床试验过程规范,数据和结果的科学、真实、可靠,保护受试者的权益和安全”、第一章总则第四条明确规定“临床试验应当权衡受试者和社会的预期风险和获益,只有当预期的获益大于风险时,方可实施或者继续临床试验。” 《药物临床试验期间安全性数据快速报告标准和程序(2018)》第九条规定(一)对于致死或危及生命的非预期严重不良反应,申请人应在首次获知后尽快报告,但不得超过7天,并在随后的8天内报告、完善随访信息。(二)对于非致死或危及生命的非预期严重不良反应,申请人应在首次获知后尽快报告,但不得超过15天。(注:申请人首次获知当天为第0天。) (3)伦理生命线 《涉及人的生命科学和医学研究伦理审查办法》第一章总则第一条明确规定保护人的生命和健康,维护人的尊严,尊重和保护受试者的合法权益,促进生命科学和医学研究健康发展。 在涉及人类受试者的医学研究中,个体研究受试者的安康必须优于其他所有利益(赫尔辛基宣言2008年,第6条)。 (4)机构责任 《药物临床试验机构管理规定》第三章运行管理第十三条明确规定药物临床试验机构是药物临床试验中受试者权益保护的责任主体。 2、国际监管趋势 (1)欧盟:建立EudraVigilance系统,SUSAR直报+AI信号挖掘(参考《我国临床试验期间药物警戒工作实践与思考》,查看链接:https://xueqiu.com/4396147139/229902087); (2)美国:FDA采用MGPS算法实时监测FAERS数据库(参考《我国临床试验期间药物警戒工作实践与思考》,查看链接:https://xueqiu.com/4396147139/229902087)。 临床试验作为药品上市环节的重要组成部分,试验过程应充分考虑受试者的安全和权益,SUSAR作为新获知的重要风险信息,能够影响受试者的风险获益比和是否能够继续开展临床试验,因此对SUSAR的管理与及时报告、评估和判断十分重要。 三 、国内顶尖医院如何管理SUSAR?(注册类药物临床试验) 四 、研究者、申办方、伦理委员会的三方协作指南 SUSAR报告的目的是让监管部门、研究者以及其他相关人员注意最新的严重不良反应重要信息,及时、准确地对SUSAR报告进行汇总分析,进行获益风险评估等方式评价试验药物的安全性,从而决定是否应该根据这些安全性信息采取相应措施(如暂停或终止临床试验等)以保护受试者安全。 只有当研究目的之重要性超过给受试者带来的风险和负担时,涉及人类受试者的研究才可进行(赫尔辛基宣言2008年,第21条)(中山大学肿瘤防治中心伦理审查指南) SUSAR管理的本质是风险控制协作链——研究者是哨兵,申办方是参谋,伦理委员会是裁判。 SUSAR发生后,研究者需做到:①客观判定;②24小时内上报;③同步伦理委员会和临床试验机构;④并定期对所有不良事件进行累积性审查。 申办者应及时监测、评估和上报药监部门,对申办者和研究者判定不一致也应快速上报。 伦理委员会应定期审查临床研究进行中受试者的风险程度。根据风险的程度,确定定期跟踪审查的频率,最长不超过1年。 临床试验机构也应不断健全药物警戒制度,以保障临床试验期间受试者的用药安全,为试验药物的安全性信息提供更多参考依据。 总结 SUSAR是临床试验安全的“晴雨表”,更是受试者权益的“生命线”。 一次及时的SUSAR报告,可能挽救的不仅是受试者生命,也是整个项目的科学性。